原子と原子の間に共有結合がどのようにしてできるのかということは、実は結構難しい問題です。陽イオンと陰イオンの間には静電気的な引力が働くことは直感的に理解できますが、中性の原子同士のあいだになぜ強い結合力が働くのかについてはかつて多くの科学者を悩ませ、そして生まれたのが共有結合の概念でした。原子は+の電気を持った原子核と-の電気を持った電子からできています。原子核同士は反発しますが、原子間に電子が入ることでそれらが引き合うようになるというのが最も単純な説明です。量子力学の言葉で言えば、原子と原子が近づくと、原子の回りの電子の軌道同士が重なることで原子間の電子密度が高まり、それによって原子間が引き合って共有結合ができると説明されます。近年のコンピュータの発展により、比較的安価なPCでも高度な量子化学計算ができるようになり、結合している原子の回りの電子の状況を可視化するのも簡単にできるようになってきました。専門的なソフトウエアも無料で手に入れられる時代です。例えば、炭素原子同士が結合するときの一つの単純な考え方は図1に示したとおりです。炭素原子の回りには原子の両側に伸びた電子の軌道があり、それらが重なることで結合ができると考えます。
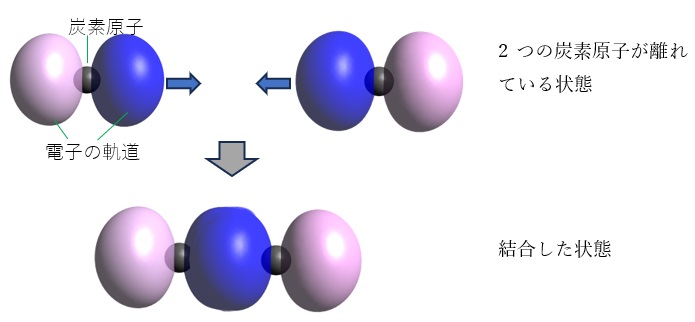 図1 2つの炭素原子が近づいてきて結合を作る様子の単純なモデル。青とピンクが炭素原子の価電子の入っている軌道のうちp軌道と呼ばれる軌道で、それらが重なることで、炭素原子間の電子密度が高くなり、結合が生じる。
図1 2つの炭素原子が近づいてきて結合を作る様子の単純なモデル。青とピンクが炭素原子の価電子の入っている軌道のうちp軌道と呼ばれる軌道で、それらが重なることで、炭素原子間の電子密度が高くなり、結合が生じる。
しかし、本当にこのような理論の通りになっているのでしょうか。電子を直接見ることはできませんが、名古屋大学の澤博教授を中心とするグループは、この命題に答えを出しました。結晶にX線をあてて調べると結晶の中の原子の位置が正確にわかるので、これによって様々な結晶内の分子構造を知る手法はよく知られています。実はこのX線回折と呼ばれる手法でわかるのは原子の位置(原子核の位置)ではなく、電子の分布状況なのです。通常電子がたくさんあるところには原子があるため、原子の位置がわかるとされます。従ってX線回折データを精密に測定し詳しく解析すると、分子やイオンの周りにどのように電子が分布しているのかがわかるのです。このことを利用して結合電子の状況を調べることは、かなり以前から行われてきました[1]。しかし、今回発表された研究では、放射光という特別に強いX線源を使って、有機物の結晶について非常に精密な測定を行い、コア差フーリエ合成法[2]という新しく開発された方法により、初めて分子中の原子間の電子分布、それも結合に直接かかわっている電子(価電子)の状況が明らかにされました。
今回調べられたのはグリシンというアミノ酸とシチジンという有機分子です[3]。グリシンは最も簡単なアミノ酸でH2N−CH2−COOHと書かれますが、通常カルボキシ基COOHの水素イオンH+がアミノ基NH2の側に移動して図2(A)のような構造になっています。この結晶の精密な測定を行い、そのデータから導き出された価電子の分布が図2(B)に表されています。この図を見ると、炭素の間に電子密度が高くなっている部分が2カ所あり、これは結合に関わっている電子の存在を示しています。炭素の回りの電子分布を詳しく見ると(図2(B)の拡大図)、それぞれの炭素原子のすぐそば(青矢印で示した部分)に価電子の密度がかなり小さい部分があることが分かりました。図には示されていませんが、左側の炭素の回りも同様でした。これは図1のような単純な考え方では説明ができませんが、新しい理論に基づく量子力学計算を行った結果と一致することが分かりました。詳細は省略しますが、炭素原子の価電子がL殻に属しており、K殻とは軌道の構造が異なるという量子力学の結果が実際に確認されたことを示しています[4]。このような細かいことまで、実際に価電子の分布を観測することに初めて成功したのです。
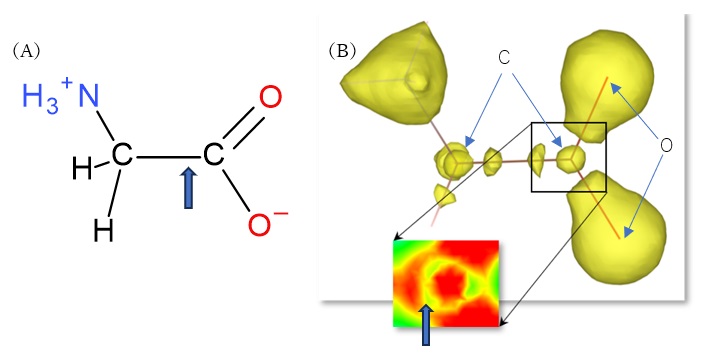 図2 (A)グリシン分子の構造。カルボキシ基COOHのH+はアミノ基NH2に移動してNH3+となっている。
図2 (A)グリシン分子の構造。カルボキシ基COOHのH+はアミノ基NH2に移動してNH3+となっている。
(B)コア差フーリエ合成法によって明らかとなったグリシンの電子密度。拡大図は炭素原子周辺の平面内の電子密度を色別に表示している。赤→黄→緑の順に電子密度が低くなる。矢印は電子密度が低くなっている部分。本図は澤教授にご提供いただいたものを多少改変(原子種や矢印等を追加)しました。
グリシンについてもう少し見てみましょう。COO−の部分は、一方の酸素と炭素の結合が二重結合で、もう一方の酸素と炭素の結合は単結合と書かれます。しかし、図2(B)でわかるように2つの酸素原子の回りの電子分布にはほとんど差がありません。これは図3 に示すようにカルボキシ基の上側のC−O結合が二重結合となっている構造と下側が二重結合になっている構造の平均が実際の構造となっている(共鳴構造という)ことを表しています。
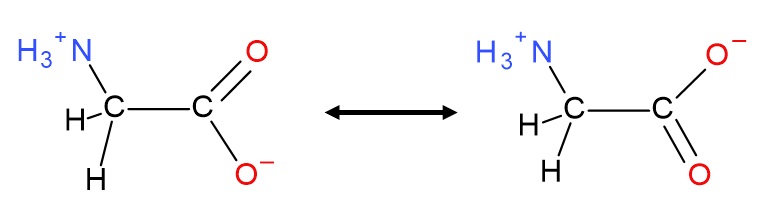
図3 グリシン分子のカルボキシ基は、図の上側のC−O結合が二重結合になっている構造と下側が二重結合になっている構造の両方の平均した構造が実際の構造と考える。このような構造を共鳴構造という。
もう一つの分子のシチジンの特徴の一つは、C−C結合に二重結合が含まれていることです(図4 (A))。二重結合というのは実際は化学式に書くように同等な結合が二本あるのではなく、通常の共有結合(炭素原子のちょうど間で電子を共有する結合)以外に、炭素原子間から少し離れたところ2カ所で電子を共有する2本目の結合(π結合という)が存在している結合です(図4(B), (C)参照)。この分子の結晶の測定結果からコア差フーリエ合成法によって、価電子の電子密度分布を計算すると、π軌道の電子(図4の(B)で紫色に示している部分)もはっきりと観測されました。
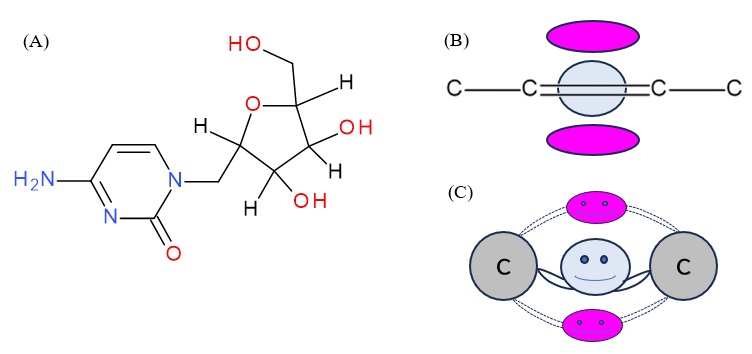
図4 (A)シチジンの構造。 (B) シチジンの芳香族環(6角形部分)平面を横から見た図。炭素原子間の1本目の結合に関わる電子(青い部分)と、二本目の結合に関わる電子(紫色の部分)。(C)二重結合のイメージ図。青の部分の電子が炭素原子をつなぐ1本目の結合に関わり、紫の部分の電子が2本目の結合に関わっている(2カ所の紫部分で1本分の結合となる)。
今回の研究は一見非常に地味な成果ですが、目で見ることができない電子の状況を詳しく“見る”ことができたという意味でインパクトの強いものと言えると思います。化学の、いや物質の本質を知る手段がこれからも次々と開発されていくことを期待したいと思います。それではまた次回。
図をご提供いただき、内容についてお教えいただいた名古屋大学の澤博教授に感謝申し上げます。
[1] 例えば斉藤喜彦 「化学結晶学入門 X戦結晶解析の基礎」共立全書、1975。
[2] S. Kitou, Y. Hosogi, R. Kitaura, T. Naito, T. Nakamura, H. Sawa, Crystals, 2020, 10, 998.
[3] T. Hara, M. Hasebe, T. Tsuneda, T. Naito, Y. Nakamura, N. Katayama, T. Taketsugu, and H. Sawa, J. Am. Chem. Soc., 2024, https://pubs.acs.org/doi/10.1021/jacs.4c05673.
[4] http://www.spring8.or.jp/ja/news_publications/press_release/2024/240724/ 論文3の内容が紹介されているプレスリリース(2024年8月1日参照)。
坪村太郎
最新記事 by 坪村太郎 (全て見る)
- 2025年 ノーベル化学賞:3次元空間を自在にデザイン。空孔をもつ錯体化合物 - 2025年12月3日
- 火星で生命の痕跡か - 2025年11月3日
- 宇宙で作った味噌 - 2025年10月6日