皆さんこんにちは。2020年のノーベル化学賞は、ゲノム編集の研究で大きな成果を得たエマニュエル・シャルパンティエ(Emmanuelle Marie Charpentier)とジェニファー・ダウドナ(Jennifer Anne Doudna)の二人の女性科学者に贈られました。残念ながらノーベル賞の授賞式が今年はオンライン開催となったそうですが、本日は彼女らの成果の中心であるCRISPR/Cas9を用いた研究1についてご紹介いたします。
まず遺伝子を構成するDNAがどのようなものだったかを復習しましょう。DNAは図1に示すように、二重らせん構造となっています2。それぞれのらせんには核酸塩基という有機分子が結合しています。核酸塩基は4種類あってそれらの配列で遺伝情報が伝えられていくのです。2重らせんの間は弱く結びついていて、比較的容易にほどけたり、つながったりすることができます。
 図1 DNAの二重らせん構造。 (左) DNAはリボン状の分子の鎖に、四角形で示された核酸塩基が結合した構造となっている。向かい合った核酸塩基は水素結合によってゆるく結びついている。(右) 核酸塩基はA,T,G,Cという記号で表される4種類があり、この4種類の並び方で遺伝情報を伝える。AはTと、GはCとしか結合しないため、2重らせんの片側だけがあれば、相手方を復元することができる。
図1 DNAの二重らせん構造。 (左) DNAはリボン状の分子の鎖に、四角形で示された核酸塩基が結合した構造となっている。向かい合った核酸塩基は水素結合によってゆるく結びついている。(右) 核酸塩基はA,T,G,Cという記号で表される4種類があり、この4種類の並び方で遺伝情報を伝える。AはTと、GはCとしか結合しないため、2重らせんの片側だけがあれば、相手方を復元することができる。
CRISPR配列の発見3
ゲノム編集ができるようになるまでには、多くの方の研究が関わっています。1987年に九州大学の石野良純先生は大腸菌のDNAの中に、奇妙な配列があることを発見されました。CGGTTTATCCCCGCTGGCGCGGGGAACTCという29個の塩基配列がくり返し見られたというものです。これにはTCCCCGCとGCGGGGAいう配列が含まれ、これは片方を逆順にすると互いに結合できる(つまり回文のようになっている)ため、この29個部分は途中で折れ曲がって互いに結合するような構造(Ωの形)になり得ます。この配列が何を意味するか当時は分からなかったそうですが、その後の研究で、このような繰り返し配列は、多くの原核生物(バクテリアなど)に見られることが分かり、CRISPR4と名付けられました。さらにこれは細菌がウイルスから身を守る免疫システムの重要な鍵であることも分かったのです。ウイルスは体内にDNAなどの遺伝情報を持っていて、感染先の細胞の中でそれを増殖してもらい自分自身を増やします。細胞がウイルスに一度感染すると、細胞はウイルスのDNAの一部を保存しておくのです(図2)。CRISPRは、先ほどのような特定の配列を隔てていくつもウイルスのDNA断片が保存されているというものでした。再度ウイルスがやってきて細胞にそのDNAが注入され、細胞内にそのDNA断片と一致するものがあると、その部分を写し取ったRNAが作られます。またCasタンパク質と呼ばれる酵素が細胞内で生産されます。このCasタンパク質が、注入されたDNA のうちRNAの配列と一致する部分を切断するのです。これによってウイルスのDNAは細胞中で増殖されなくなります。
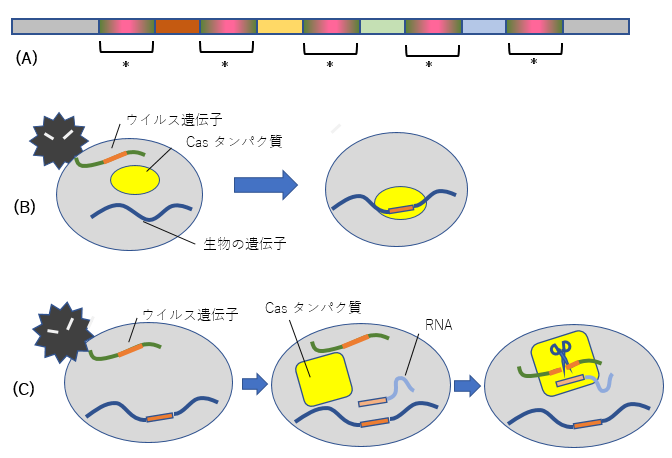 図2 (A) 大腸菌で発見されたDNAの繰り返し配列CRISPR。*で表した同じ配列がくり返し現れている。*と*の間にあるのが外来ウイルス由来のDNA断片。(B) ウイルスが生物にとりつき、DNAを注入した際、ウイルスのDNAの一部を生物の遺伝子に取り込んでおく。これはCasタンパク質によって行われる。(C) 再度同じウイルスが来て、以前取り込んだ断片を含むDNAが注入された場合、その遺伝情報を伝えるRNAが生産され、この情報を元に、Casタンパク質(前述のCasタンパク質とは異なる)がウイルスの遺伝子を切断してウイルスの増殖を防ぐ。
図2 (A) 大腸菌で発見されたDNAの繰り返し配列CRISPR。*で表した同じ配列がくり返し現れている。*と*の間にあるのが外来ウイルス由来のDNA断片。(B) ウイルスが生物にとりつき、DNAを注入した際、ウイルスのDNAの一部を生物の遺伝子に取り込んでおく。これはCasタンパク質によって行われる。(C) 再度同じウイルスが来て、以前取り込んだ断片を含むDNAが注入された場合、その遺伝情報を伝えるRNAが生産され、この情報を元に、Casタンパク質(前述のCasタンパク質とは異なる)がウイルスの遺伝子を切断してウイルスの増殖を防ぐ。
生化学者達はこの仕組みを遺伝子改変に利用できるのではないかと考えました。そして2011年から始まった先の2人の科学者の共同研究によってCISPR/Cas9を用いる方法が見いだされました。この方法では改編したい遺伝子部分の配列を持ったガイドRNAを用意します。これとCas9と呼ばれるタンパク質を改編したい細胞に入れるだけです(といってもそこには様々な技術があるそうです)。そうすると図3に示すように、ガイドRNAの配列を元にCas9はDNAの部位を認識して、正確にDNAを切断します。細胞はDNAの修復機能を備えているために、そこに鋳型用DNA(切断されたDNAの両側の配列を持っているもの)を入れておけば、切断されたDNAを修復するときに、鋳型DNAの中心部分に相当する配列が切断部分に挿入されます。
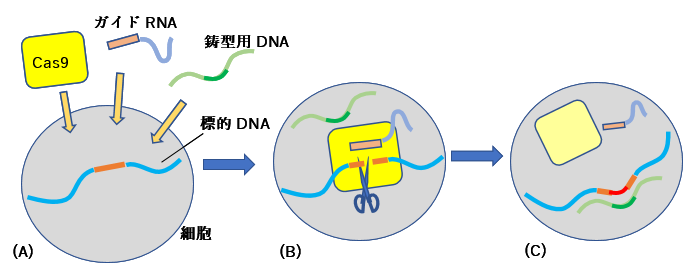 図3 CRISPR/Cas9を用いたゲノム編集の概要 (A) 標的遺伝子を含む細胞にCas9酵素とDNA中の特定部位を認識するガイドRNA、そして標的遺伝子にDNA断片を組み込むための鋳型DNAを注入する。 (B) ガイドRNAが標的遺伝子を認識し、Cas9が遺伝子の特定部位を切断する。(C)切断された部分の両側と同じ配列を持つ鋳型用DNAの中心部分(赤色)が標的遺伝子に組み込まれる。
図3 CRISPR/Cas9を用いたゲノム編集の概要 (A) 標的遺伝子を含む細胞にCas9酵素とDNA中の特定部位を認識するガイドRNA、そして標的遺伝子にDNA断片を組み込むための鋳型DNAを注入する。 (B) ガイドRNAが標的遺伝子を認識し、Cas9が遺伝子の特定部位を切断する。(C)切断された部分の両側と同じ配列を持つ鋳型用DNAの中心部分(赤色)が標的遺伝子に組み込まれる。
このシステムは、従来報告されてきたゲノム編集の方法に比べて圧倒的に簡便であり、瞬く間に世界中に広がって、周辺技術の改良や応用面の開拓が行われています。遺伝子を自在に操ることなど遠い未来のことだと思っていましたが、もう現実のものとなっているのは全く驚きです。病気の治療を含む様々な応用が可能になる反面、ゲノム編集による倫理面の問題もクローズアップされてきています。この分野の発展は目が離せませんね。ではまた次回お会いしましょう。
1)詳しくはノーベル財団のHPに解説があります。https://www.nobelprize.org/prizes/chemistry/2020/advanced-information/
2)図1のデータはhttps://www.rcsb.org/structure/1bna、Protain data bankより採録。データの元文献はDrew, H.R., Wing, R.M., Takano, T., Broka, C., Tanaka, S., Itakura, K., Dickerson, R.E., Proc. Nat. Acad. Sci. USA 78, 2179-2183 (1981).
3)石野良純、生物工学会誌、94、336-342 (2016).
4)Clustered regularly interspaced short palindromic repeats, 「周期的に隔たれた短い回文配列を含む繰り返しからなるクラスター」と訳することができる。またCasはCRISPR associated protein (CRISPR付随タンパク質)の略。
坪村太郎
最新記事 by 坪村太郎 (全て見る)
- PFAS等のフッ素化合物を容易に変換する化学反応の発見 - 2025年3月3日
- モリブデン鉱物を食べて窒素を反応させる微生物 - 2025年2月3日
- 石英の鉱脈に金が析出するわけ - 2025年1月13日